一 向 庵
変異原性試験の発足の思い出
化学物質安全性評価コンサルタント(医学博士)石館 基
II. 試験法ガイドラインの確立
がんの発生は、細胞の突然変異によって起こることは周知の事実である。突然変異は、DNAの損傷が修復する時のエラーによっても起こるし、遺伝子自身の変異によっても起こる。また、遺伝子を担う染色体(染色体一本には1000個以上の遺伝子が存在している)に構造上の変化(切断や乗り換えなど)や数的異常(異数性)によっても起こり得る。従って、変異に関係するこれらの遺伝学的指標をすべてカバーし得る試験系を適切に選択する必要性が生まれた。
DNAの損傷を指標とする試験には、枯草菌を用いる修復試験(rec-assay)や肝細胞を用いる不定期DNA合成(UDS)試験などが挙げられる。突然変異を指標とする試験には、既にデータが蓄積されているAmes 試験が主流を占めた。この系では、感受性が高められた数種類のサルモネラ(S.typhimirium)および大腸菌(E. coli)を用いるが、試験によって被験物質の作用機序(塩基置換型あるいはフレームシフト型の変異)が見られるばかりではなく、変異原性の強さ(変異活性)を比較することも可能である。また、染色体異常試験では、チャイニーズハムスター線維芽細胞株のCHL/IU(肺由来)あるいはCHO(卵巣由来)やヒト抹消血のリンパ球を用いて、染色体の構造および数的異常を観察することが出来る。わが国では、特にCHL/IU細胞を用いる試験のデータが蓄積していた。一方、米国のNTP(毒性計画)ではCHOのデータが好んで用いられて来た。
既知発がん性物質の中には、Ames 試験で陽性を示さなくても、培養細胞による染色体異常試験で陽性となるものがある。また、逆の結果を示す場合もある。これらの試験が互いに遺伝学的指標を異にするためである。従って、一方の試験だけでは不十分であり、発がん性物質を取りこぼす可能性があり、両者の試験が互いに相補的な役割を演じていることが分かった。前記(Ⅰ 試験法開発の時代 参照)WHO/IPCSによる国際協力事業では、Ames 試験で検出されにくい8種類の化学物質(ヘキサメチルフォスフォラミド、オルト‐トルイジン、サフロール、アクリロニトリル、DEHP、フェノバルビタールなど)を取り上げたのだが、その大半のものは培養細胞を用いる染色体異常試験で陽性となった。
生体外(in vitro)試験では、被験物質の代謝活性化を促進するために、特にラットの肝臓ホモジェネート(S9)が用いられている。しかし、これだけでは実際に生体内(in vivo)での事象を反映するかどうかは不明である。例えば、プロピレンオキシドはin vitro の試験では陽性となるが、マウスを用いる小核試験では陰性である。この物質は生体内で速やかに水酸化されて、変異原性のないプロピレングリコールに変わり、後者には変異原性がないからである。従って、in vitro試験だけでは不十分であり、動物個体を用いるin vivo試験を追加する必要がある。
in vivo試験としては、古くから、ラットの骨髄細胞を用いる染色体異常試験が用いられていた。しかし、骨髄の染色体の解析には豊富な細胞遺伝学的知識と技術が要求される。そこで、ドイツのSchmidらは、その代替としてより簡単なマウス小核試験法を開発した。私は早速彼に会い、その有用性について検討した。多少プロトコールに問題はあるものの、この方法は極めて有用であり、わが国でも起用すべきであるとの結論に達した。
医薬品をはじめ、食品および食品添加物、農薬、化粧品、医療用の材料、その他の化学物質の安全性を確認する上で、行政的にどのような試験(遺伝毒性試験)を採用するべきかという問題は極めて重要かつ深刻な問題であった。早速、専門家委員会を招集し、諸外国の情勢を考慮した上でこの問題に取り組んだ。当時国立遺伝学研究所におられた賀田恒夫先生および土川清先生、東大医科学研究所の松島泰次郎先生、企業の代表として武田薬品の菊池基康先生と私などが加わって、意見諤々の熱い論争をしたことを思い出す。
その結果、Ames試験、培養細胞を用いる染色体異常試験およびマウス小核試験の3点を最少試験項目として取り上げた。その後、それぞれの試験の具体的な試験法ガイドラインを作成することになる。
次の問題は、これらの試験を対象物質別にどのように組み合わせるべきかについて検討された。この結果は、UKおよびOECDなどの国際的なガイドラインの作成に大きく貢献することになる。
試験の組み合わせには、大きく分けて、3通りの考え方があった。
- 段階:ある試験の結果を見て、次の試験に進むという考え方である。
- バッテリー説:複数の試験を平行して同時に実施するという考え方である。
- 組み合わせ説:1. および 2. の方法を組み合わせて実施するという考え方である。
わが国では、原則として、第3の考え方を採用することになった。しかし、行政的には、対象物質によってその対応を考える必要がある。
わが国の労働安全衛生法(安衛法)では、化学物質を取り扱う従事者への有害性を考慮し、行政的指導をすることを目的としている。これには、まず、Ames試験を実施し、その結果を定量的に評価し、活性が高いと判断された場合には、更に培養細胞を用いる染色体異常試験を追加し、両者の試験で疑わしい結果が出た場合に、発がん性の可能性を考慮した上で、取り扱い上の注意を公表することになっている。
一方、医薬品(薬事法)、食品添加物、あるいは農薬(農薬取締法)の場合には、不特定多数の人々を対象とするため、上記3種類の試験をバッテリー法で実施し、更に、必要に応じて、他の試験を追加するよう勧告されている。特に、製薬会社の場合には、動物試験の施設があるため、生体内の試験を実施することに、あまり抵抗はない筈である。
また、新規化学物質(化審法)の届け出に当たっては、スクリーニング試験として同様な考え方が適用されており、Ames試験および染色体異常試験の結果を定量的に評価すると共に、28あるいは90日間の動物を用いる反復投与毒性試験(亜急性的試験)によって、臓器特異性を含めて、総合的な評価が行われている。
試験法の組み合わせスキームについては図3を参照されたい。これらの考え方は、生産者自らが、その対象物質に応じて、適切な組み合わせを検討すべきであろう。
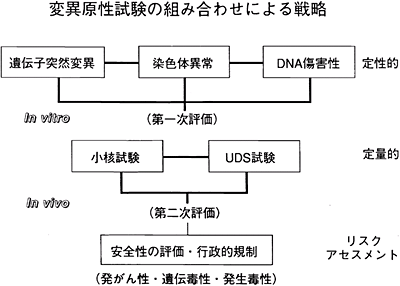
図3 試験法の組み合わせスキーム
なお、培養細胞では、染色体異常の代わりに、小核の誘発性を見る試験(in vitro小核試験)あるいはマウスリンパ腫細胞を用いる突然変異試験(リンフォーマアッセイ)を選択してもよいことになっている。しかし、著者の個人的な知見では、前者は染色体異常の構造異常と数的異常を同時に見られるという利点はあるが、小核の判定にやや問題が残されている。また、後者は、感受性が高く、他の試験と比べて、やや陽性率が高い傾向にあり、発がん性との関連性を考慮すると、偽陽性(false positive)が増えるのではないかという懸念もある。
米国では、色々な試験法を提示し、生産者が適切と思われる試験を選択する自由さが与えられている。UKあるいはEUでは、特に、医薬品について、以下に示す5つの試験系(ICHガイドライン)のうち、4つの試験が推奨されている。当然のことながら、試験系を選択した理由を明記しなければならない。
- 細菌を用いる遺伝子突然変異試験
- 培養細胞を用いる染色体異常試験あるいはマウスリンフォーマ試験
- 培養細胞を用いる体細胞突然変異試験
- げっ歯類を用いる小核試験 (骨髄細胞を用いる染色体異常試験を含む)
- げっ歯類肝臓細胞を用いる不定期DNA合成(UDS)試験
これらの試験はいずれも安全性試験実地基準(GLP)に基づいて実施されなければならない。GLPは1976年頃、米国FDAに提出された医薬品の安全性試験申請データに不正が発覚されたことから始まった。わが国でも、1983年以降から実施されているが、試験機関にとってはかなり厳しい規制となった。しかし、この適用によって、自社の安全性試験が正当化されるばかりではなく、受託試験施設のハードおよびソフト面での質的向上に大いに役立ったのである。1979年以降、国際的専門家グループによってOECD-GLPガイドラインも作成されている。
なお、Ames試験のガイドラインおよびCHL/IU細胞を用いる染色体異常試験法ガイドラインの解説については下記の文献を参照されたい。
- 労働省化学物質調査課(編):安衛法における変異原性試験-テストガイドラインとGLP、中央労働災害防止協会(1991)
- 石館 基著:GLPに基づく染色体異常試験ガイド、LIC/東京(2006)
III. 環境変異原の検出
試験法の確立に伴い、我々の環境中には色々な変異原性物質が存在することが分かって来た。即ち、変異原の検出の時代に入った。その最たるものは、魚の焦げの成分であろう。国立がんセンターの杉村隆先生のグループによって、熱処理によって生ずる、今までに知られていなかった強い変異原性物質、ヘテロサイクリックアミン類が続々と検出された。これら一連の化合物には、後に発がん性も認められている。
当時岡山大学におられた早津彦哉先生らのグループは、青色のチョークに含まれる銅キレート化合物が環境中の変異原を吸収する性質のあることを発表した。この綿を用いると、河川に含まれる変異原が容易に検出出来る。また、大気汚染物質については、主に福岡県衛生公害センターの常盤寛先生、国立公衆衛生院の松下秀鶴先生らのグループによって、多くのデータが発表されている。
もう一つ特記すべきことは、衛研の能美健彦、渡部雅彦先生らによって新しくサルモネラYG亜系株が開発されたことである。プラスミドによる遺伝子組み換えによって樹立されたこれらの菌株は、特定な変異原に対して数100倍も高い感受性を示した。従って環境中にごく少量しか存在しない変異原でも効率よく検出することが可能となった。この「YG」の語源が当研究所の所在地「用賀」に由来することはご存知であろうか。ちなみに、染色体異常に用いられているCHL/IU細胞の「IU」は、著者と当時大塚の癌研におられた宇多小路正先生のイニシャルであることも付け加えておこう。YG株の文献、CHL/IUの由来については、下記の文献を参照されたい。
- 渡部雅彦ら:ニトロアレーン、芳香族アミンに高を示すTA98およびTA100の新しい誘導株の樹立、環境変異原研究、11, 67-74 (1989)
- 石館 基:CHL/IU細胞の起源について、生体の科学、43, 446-447 (1992); 蛋白質・核酸・酵素、33, 2830-2837 (1988)
- Ishidate, M., Jr. & Odashima S: Mutation Res., 48, 337-354 (1977)
その後の研究によって、更に色々な変異株が追加された。これらは、細胞・遺伝子バンク(後述)に保存されている。
(最終回に続く)
最終回掲載予定
IV. 変異原性、発がん性の機構の究明
解熱鎮痛剤フェナセチンには弱いながら発がん性が認められているが、通常のAmes試験では検出されにくい。
しかし、ハムスターのS9を用いると、変異原性が発現される。
V. 変異原性試験の結果の評価
in vitro およびin vivo試験の結果を総合して、変異原性を論ずるべきだと思う。
|